【クローズアップ】小林製薬「紅麹」事件の波紋 崩壊した機能性表示食品の“安全神話”
小林製薬(株)
小林製薬(株)の紅麹原料をめぐる問題は、食品業界全体を巻き込む事件へと発展。腎疾患の発症に加え、死亡事例が連日報告されるなど深刻さは増すばかりだ。その原因と疑われているのが、健康維持を目的とした機能性表示食品であるだけに、関係業界に衝撃を与えた。原因究明は困難を極め、再発防止策を打ち出せるかどうかも不明だ。
問題視されるのはサプリメント用途の原料
健康被害の原因と疑われているのが、小林製薬(株)が販売した機能性表示食品のサプリメント「紅麹コレステヘルプ」。関与成分として米紅麹ポリケチドを配合。LDL(悪玉)コレステロールが高めの方に適している旨をうたう。この商品に使用される同社の紅麹原料が、何らかの理由によって腎疾患を引き起こした疑いがもたれている。

米・麦・大豆などの穀類に、食品の発酵に役立つカビを繁殖させたものを麹と呼ぶ。日本酒やしょうゆ、みそ、酢といった伝統的な食品の製造に用いられる。麹には多くの種類がある。たとえば、日本酒やしょうゆの製造には黄麹菌、泡盛には黒麹菌を使用する。
紅麹は、麹菌の1種である紅麹菌を米に付着させて培養させたもの。ここで留意したいのは、今回の問題でクローズアップされた小林製薬の紅麹原料は、サプリメント用途として開発・製造されたものであること。沖縄の「豆腐よう」の製造に欠かせない従来の紅麹とは製造方法などが異なり、“別物”と考えなければならない。
同社の紅麹原料はもともとグンゼ(株)が保有していたが、2016年に小林製薬へ譲渡。その後、小林製薬では紅麹原料を使用したサプリメントの開発や、他社への原料供給を本格化させていく。当初、特定保健用食品(トクホ)の開発を目指したものの、採算面から実現しなかった。それに代わって、21年に低予算で開発できる機能性表示食品として登場。今回の健康被害の原因と疑われる「紅麹コレステヘルプ」である。
同社によると、サプリメント用途の紅麹原料には“意図しない成分”が含まれていたが、食品の風味付けや着色に用いる紅麹には含まれていなかった。
消費者にとってはその違いが理解しがたく、紅麹を用いたあらゆる食品を不安がる傾向にあり、深刻な風評被害が生じている。従来の紅麹を使用する食品企業にとっては、はなはだ迷惑な話だろう。
入院93人、死亡4人の甚大な被害
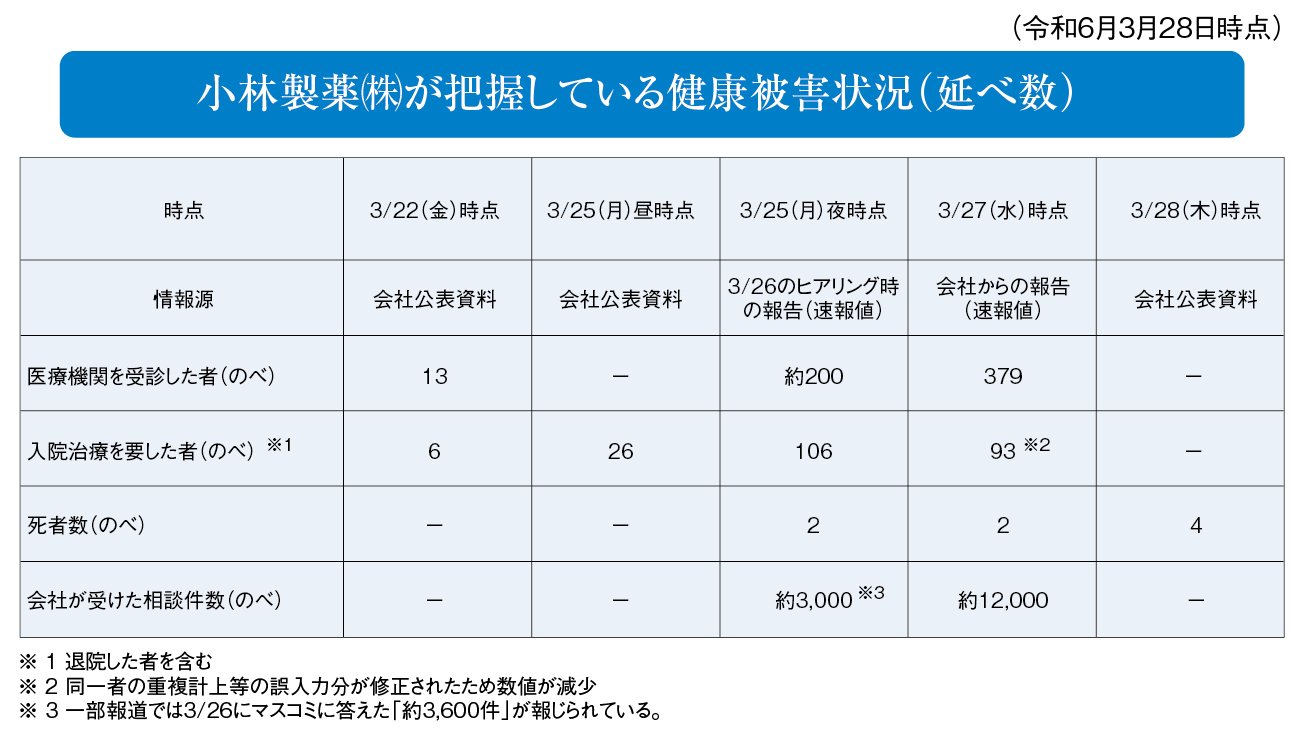
これまでの経緯を振り返る。3月22日午後6時、小林製薬は大阪で記者会見を開催。同社の機能性表示食品を摂取した人で健康被害が発生したことが報告された。この時点では健康被害を訴えた人が13人、入院が6人で、“序章”にすぎなかった。また、1~2月にかけて、医療機関や患者から連絡が入ったという説明があった。およそ2カ月もの間、社内で検討していたことになる。
実は、消費者庁へ同社から一報が入ったのは、記者会見前日の21日だった。自見はなこ消費者担当大臣は26日の記者会見で、報告が遅れたことに「誠に遺憾である」と怒りをにじませた。
同社の記者会見は金曜の帰宅時間帯だったこともあり、たまに起こる大手企業による自主回収問題として受け止められたようだった。一方、そうでない人たちもいた。健康食品業界の関係者である。というのも、機能性表示食品で初めて重篤な健康被害が発生したためだ。業界団体のある幹部は「大ごとになるかもしれない」と、対応に追われる可能性を口にした。
その予感は的中した。週明けの25日には入院患者が26人に増加。小林製薬の紅麹原料を使用した各社では、商品回収に乗り出した。
26日、同社は「紅麹コレステヘルプ」の購入者が腎疾患で死亡したと発表。厚労省は大阪市に対し、3商品を対象に廃棄命令を指示した。もはや、単なる食品事故のレベルではなく、政府全体で対応に乗り出す事態に。27日時点の入院患者数は重複を除くと93人、死亡事例が4件。同社への相談件数は1万2,000件に達した。
難しい微生物のコントロール
小林製薬は紅麹原料を「大阪工場」(大阪市淀川区)で製造していた。同工場はすでに閉鎖されているが、取材に対し、健康被害の原因と疑われるサプリメント用途の紅麹原料については「2023年12月までに大阪工場で製造されたもの」(広報)と説明。現在は協力会社の和歌山県内にある工場で製造している。
原因究明は困難を極めている。生産現場がすでに閉鎖され、時間も経っていることから、検証も難しい。原料に含まれていた意図しない成分の解明がカギを握るが、「プベルル酸」と固定できたにすぎない。
今回の問題で注目されるのは、原因と疑われる食品が発酵物であること。「紅麹コレステヘルプ」の関与成分は米紅麹ポリケチド。しかし、同商品に用いた紅麹原料は発酵物であり、関与成分以外にもさまざまな成分が含まれている。同社では「機能性関与成分の濃度や一般的な各種検査は行った」(広報)が、原料に含まれるすべての成分の検査は実施していないという。
ただし、紅麹特有の腎疾患を引き起こすカビ毒「シトリニン」は含んでいなかった。同社が使用する紅麹菌は、シトリニンを生成しない性質をもつためだ。
しょうゆ、日本酒、みそといった昔からある食品も発酵物だが、これらは長い年月をかけて多数の企業によって安全性が担保されてきた。業界全体で十分な知見を保有しているわけである。
一方、サプリメント用途の原料は、各社独自の抽出方法や製造方法によって製造され、新規性が高い。このため、製造・品質管理に関する知見が乏しい。さらに、菌を用いた発酵物の場合、製造工程上のコントロールは容易でない。
今回の問題についても、同社独自の新規の原料、コントロールが難しい発酵物という条件が重なったことが遠因になったという見方もできそうだ。
173社が小林製薬の紅麹原料を調達
厚生労働省は28日、専門家会議を開き、小林製薬の紅麹原料の販売先となった173社を公表した。小林製薬が直接卸している企業は52社を数え、この52社が173社へ供給していた。173社には、健康食品の主要な受託製造会社をはじめ、酒・みそ・パンのメーカーなどが並ぶ。
厚労省は173社に対し、4月5日までに、健康被害情報の有無を報告するように求める方針だ。(1)小林製薬の3商品(コレステヘルプ、ナイシヘルプ+コレステロール、ナットウキナーゼさらさら粒GOLD)に使用された原料を同等量以上含む商品、(2)過去3年間で医師から健康被害が1件以上報告された商品―の有無について自主点検させることを決めた。
また、健康被害の原因となった成分については、国立医薬品食品衛生研究所が解明に乗り出すこととなった。
機能性表示食品制度を所管する消費者庁では、これまでに届け出された約7,000件の機能性表示食品を対象に、総点検を実施する。3月28日付で約1,700社に質問状を送付し、4月12日をメドに回答するように求めた。
質問の内容は、医師から重篤な被害情報が寄せられたかどうか、情報収集体制が機能しているかどうか、に集約される。質問事項をこの2点に絞り込むことで、迅速な回答を求める考えだという。
3月28日の定例記者会見で、消費者庁の新井ゆたか長官は、「医師から重篤な被害情報がもたらされたのであれば、消費者庁も加わって調査しなければならない」と話した。
機能性表示食品制度が抱える問題点とは?
消費者庁 新井ゆたか長官
重篤な健康被害が発生したことを受けて、小林製薬などの2社は機能性表示食品の届出を撤回した。小林製薬は「コレステヘルプ」「いきいきヘルプ」「ナットウキナーゼさらさら粒GOLD」「ナイシヘルプ+コレステロール」などの8件。残りの1件は、(株)ZERO PLUSの「悪玉コレステロールを下げるのに役立つ 濃厚チーズせんべい」。
届出が撤回されたものの、消費者庁では2社に対し、安全性の科学的根拠を再検証し、報告するように求めている。だが、2社の届出資料を見る限り、安全性に関する科学的根拠については、特段おかしいと感じさせる点は見当たらない。
2社の届出内容よりも、むしろ機能性表示食品制度の仕組みが機能していないことに問題があると考えられる。
機能性表示食品の場合、食経験の評価による安全性確認が可能。届出の大半が、食経験の評価を選択している。これは、販売商品を用いた安全性試験を実施すると多額の費用がかかるが、食経験の評価ならば費用も時間も最小限で済むためだ。中小企業も活用できる制度を目指した観点からは、制度設計としては妥当な判断だったといえる。
ところが、15年の制度開始直後から、目を疑うような届出が相次いだ。たとえば、わずか10カ月程度の食経験を安全性の根拠とした商品も見られた。そうした状況は現在も続いている。新たに開発された原料を用いた機能性表示食品が次々と登場しているが、食経験としては数年程度、長くても10年ほどしかなく、本来、食経験で評価するのは不適切となる。
こうした届出は問題視されてきたが、届出企業に強くいえない事情もある。制度の創設に向けた検討会では、どの程度の期間があれば食経験として十分かという議論が行われ、米国食品医薬品局(FDA)の「目安として広範囲に最低25年摂取されている」という考え方などが参考に挙げられたものの、学術界で統一した見解がないことから、具合的な線引きを断念した経緯がある。適切な目安がないために、食経験が極端に短いケースでも「ダメ」といえないわけだ。
わずか数年程度の食経験によって安全性を確認したとする届出は、線引きがないことを逆手にとった悪質な行為という見方もできる。そうした届出が横行し、市場で機能性表示食品として流通しているのが実態だ。
野放し状態にある新規の原料
健康食品の安全性を考えるうえで、もう1つ重要な課題がある。今回の事件でも、伝統的な紅麹とは異なるサプリメント用途の紅麹原料が問題となった。製法などが違えば、新たに開発された原料に該当するため、より慎重な管理が求められる。
しかし、日本では新規の原料であっても、昔からある原料であっても、同じように食品に使用できる。つまり、トクホや指定添加物などを除けば、新規の原料を野放しにしているわけだ。
一方、米国やEU、ASEAN諸国など世界の主要国では、新規の食品・成分に厳しい規制を敷いている。健康食品分野に詳しい(株)グローバルニュートリショングループの武田猛代表は、健康被害の防止に向けて、「日本も(EUなどで見られる)ノベルフード制度を導入し、国が関与する必要がある」と提言する。
小林製薬のサプリメント用途の紅麹原料についても、本来ならば新たに開発された新規の原料として位置づけて、健康被害防止の観点から、国によるチェックが必要だったのかもしれない。
今回の騒動はまだ沈静化する気配が見えない。意図しない成分(プベルル酸)と腎疾患との因果関係が解明されるか、混入した原因が究明されるのか、その見通しは不透明だ。これらが解明されなければ、再発防止策を構築することもできない。そうなると、消費者の機能性表示食品への信頼は著しく低下し、制度の発展と市場拡大に終止符が打たれると予想される。
【木村 祐作】
<COMPANY INFORMATION>
代 表:小林 章浩
所在地:大阪市中央区道修町4-4-10
設 立:1919年8月
資本金:34億5,000万円
売上高:(23/12連結)1,734億5,500万円